Cómo analizar el genoma fetal en una muestra de sangre materna
Todos sabemos que el feto se aloja en el útero materno donde crece tranquilamente. Lo que quizás desconozcan es que casi desde el primer momento su ADN se dispersa por todo el sistema circulatorio de la madre.
Recordemos que la gestación comienza con la fusión de los gametos: el óvulo materno y el espermatozoide paterno. La fecundación da lugar al cigoto, una célula gigante que se divide muchísimas veces hasta ser una pelota de células llamada mórula. Hasta aquí todas las células eran iguales, pero ahora unas se van a Houston y otras a California ya que tiene lugar la primera diferenciación celular que culmina en el blastocisto.
En el exterior del blastocisto encontramos las células que crearán el trofoblasto, antecesor de la placenta. El trofoblasto está a su vez formado por el citotrofoblasto en la parte interior, y el sincitiotrofoblasto en la parte exterior. Esta última capa es más gruesa y es la encargada de fusionarse con el endometrio materno en la implantación y de gestionar el intercambio de nutrientes, oxígeno y deshechos entre el feto y la madre. En el interior del trofoblasto queda un grupito de células que a lo largo de los meses construirá el cuerpo del embrión.
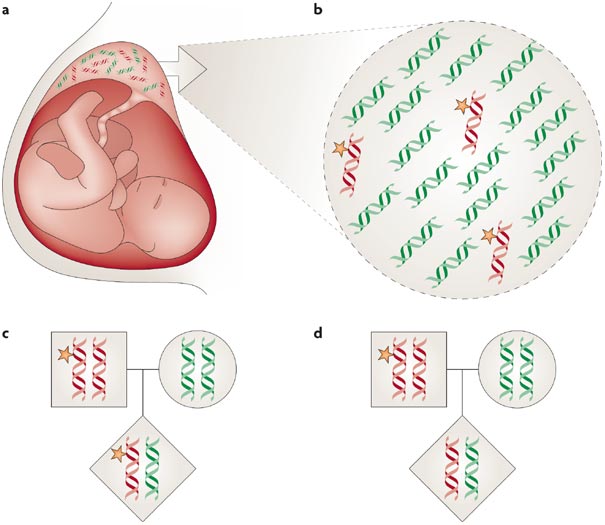
El trofoblasto sufre muchos cambios durante la gestación. Hay células que mueren y son sustituidas por otras más jóvenes y fuertes. De estas células caídas se desprenden moléculas de ADN que a través del útero entran en la circulación materna. Es aquí cuando a una persona brillante se le ocurrió que estudiar los fragmentos de ADN libre en el plasma sanguíneo podría ser una buena manera de detectar anomalías cromosómicas del feto mediante una técnica no invasiva.
Así se diseñó el test de secuenciación de ADN libre fetal (cfDNA). A partir de una muestra de sangre materna, parecida a la que se toma para un análisis de sangre convencional, se identifican los ácidos nucleicos del feto y se reconstruye a grandes rasgos su genoma. Para obtener un resultado fiable se realizan dos aproximaciones que son interpretadas en conjunto. En primer lugar se realiza una secuenciación completa para determinar cuántos fragmentos hay de cada par de cromosomas. Si entendemos nuestro genoma como una enciclopedia formada por 23 pares de tomos podríamos decir que aquí se mira cuántos capítulos hay de cada tomo. Si por ejemplo hay más capítulos de la cuenta de la 21ª pareja puede que tengamos un cromosoma extra, (trisomía) y si por el contrario hay menos capítulos de los esperados puede que falte uno de los cromosomas (monosomía).
En segundo lugar se realiza una secuenciación dirigida. En este caso se buscan polimorfismos de un único nucleótido (SNPs), secuencias concretas de cada uno de los cromosomas. Podríamos decir que ahora se observan fragmentos concretos de cada cromosoma donde sabemos que aparece una secuencia determinada y heredable, algo así como una señal. En esta aproximación se recuentan todas las señales y se clasifican según el cromosoma al que pertenecen y el progenitor del que han sido heredadas. Es una metodología un poco más fina y permite obtener una conclusión de la dotación cromosómica fetal más sólida.
Debemos tener en cuenta que en el torrente sanguíneo también hay ADN libre de la madre. Antes de comenzar la secuenciación hay que comprobar que la fracción fetal supera un umbral mínimo detectable, es decir, en el total de cfDNA debe haber un porcentaje mínimo procedente del feto. De media hay que esperar hasta la décima semana para que este valor sea detectable, pero en mujeres con desordenes metabólicos, obesidad o fecundadas por reproducción asistida la fracción fetal tiende a ser menor.
El análisis de ADN libre fetal ya se encuentra disponible en algunos laboratorios especializados de diagnostico molecular, y se recomienda en mujeres que presentaban embarazos de riesgo, donde la probabilidad de que el feto sufra una anomalía cromosómica es más alta. Sin embargo los expertos señalan que esta técnica se podría extender a todos los embarazos como estudio de chequeo prenatal básico no invasivo para el síndrome de Patau, trisomía del cromosoma 13; el síndrome de Edwards, trisomía del cromosoma 18 y el síndrome de Down, trisomía del cromosoma 21.
Hasta el día de hoy el diagnóstico prenatal no invasivo se basa en análisis de sangre materna y ecografías para determinar la translucencia nucal. Algunas alteraciones genómicas provocan una acumulación de líquido en la zona de la nuca, así que sobre la doceava semana se mide este parámetro. Esta técnica tiene un error considerable ya que al fin y al cabo esa imagen se obtiene mediante radiofrecuencias y es de baja calidad. Normalmente cuando estas pruebas señalan una anomalía o en casos de embarazos de riesgo se acude a una prueba INVASIVA de confirmación. Puede ser una amniocentesis, donde se toma una muestra de líquido amniótico, ese que baña al bebé, para analizar las muestras de DNA fetal suspendidas, o un análisis de vellosidades coriónicas, donde se estudia un trocito de la placenta. La ventaja de esta última técnica es que se puede tomar esta muestra a través del cuello uterino sin tener que perforar la placenta.
Una de las principales ventajas de la secuenciación de ADN libre fetal que disminuyen drásticamente los falsos positivos. Casi el 90% de las mujeres que erróneamente pensarían que su bebé tiene una anomalía obtendrían un resultado más cercano a la realidad de su embarazo.
Es muy importante informar correctamente a las mujeres de qué se está haciendo y qué significan los resultados. Se ha comprobado que muchas embarazadas desconfían de una técnica que se basa simplemente en una muestra de sangre, a pesar de que sea más efectiva que las técnicas convencionales. Además los expertos advierten que esta prueba tiene una última peculiaridad a tener en cuenta. En ocasiones los “falsos positivos” no se corresponden con la dotación cromosómica fetal sino con la materna. Es decir, puede ocurrir que el feto esté en perfectas condiciones pero la madre tenga una alteración cromosómica asintomática desconocida, o en el peor de los casos, puede que esté desarrollando un tumor. Esto reafirma cuán importante es informar correctamente a la madre.
Por último los manuales recogen una serie de situaciones donde es más común que aparezcan falsos negativos. En primer lugar se incluyen los embarazos múltiples donde uno de los fetos muere prematuramente y es reabsorbido. En estos casos los restos del ADN libre fetal de este hermano puede circular por la sangre materna enturbiando los resultados. Por otro lado se encuentra el caso de mujeres que han recibido una donación de médula ósea. Pueden aparecer fragmentos de cfDNA procedentes de las células donadas y confundirse con las del feto. En tercer lugar existe la posibilidad de que aparezca el mosaicismo fetal, una anomalía donde únicamente la placenta tiene una dotación cromosómica aberrante, mientras que el feto no. Esto se debe a que en los primeros estadios de la gestación, en esa pelota de células inicial, la célula precursora del trofoblasto sufre una división errónea. Todas sus descendientes heredarán esa anomalía, mientras que las células que forman al embrión son independientes a este suceso. En este caso sólo la amniocentesis nos dará un resultado verdadero del estado del feto.
Sea como sea, el diagnóstico prenatal, como cualquier otro ámbito de la medicina, está determinado a avanzar y acoger nuevas técnicas moleculares de análisis, más fiables y asequibles cada día.
Diana W. Bianchi, M.D., and Rossa W.K. Chiu, M.B., B.S., Ph.D.
Articulo original: http://sitn.hms.harvard.edu/flash/2018/using-genetics-fight-cancer-pros-cons-direct-consumer-testing/